Inti atom
Puseur tina atom disebut inti atom atawa nukleus. Inti atom diwangun ku proton jeung neutron. Lobana proton dina inti atom disebut nomer atom, sarta nangtukeun rupa unsur atom éta.
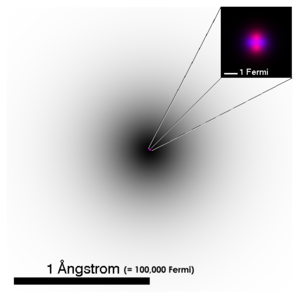
Ukuran inti atom jauh leuwih leutik ti ukuran atomna sorangan, sarta lolobanaana kasusun ku proton jeung neutron, ampir sama sakali euweuh sumbangan ti éléktron.
Jumlah neutron dina inti atom nangtukeun isotop unsur atom kasebut. Jumlah proton jeung neutron dina inti atom silih pakait; biasana dina jumlah anu sarua, dina nukleus badag aya kaleuwihan jumlah neutron ti jumlah proton. Dua jumlah kasebut nangtukeun jinis nukleus. Proton jeung neutron mibanda massa anu ampir sarua, sarta jumlah dua massa proton jeung neutron ieu disebut nomer massa, sarta beuratna ampir sarua jeung massa atom (unggal isotop mibanda massa anu mandiri). Massa éléktron pohara leutik sarta henteu réa pangaruhna kana massa atom.
Penampakan nuklir
éditHiji inti atom (nuklir) diwangun ku proton jeung neutron anu silih tarik kacida kuat. Gaya éléktromagnét anu ngabalukarkeun sarupaning arus (muatan), nyegah proton nyieun iketan tanpa neutron (gaya éléktromagnétik kasebut baris ngancurkeun inti nuklir sarupaning éta - iketan tanpa neutron). Sabot neutron jeung proton aya dina jarak anu pohara deukeut, maranéhanana ditahan ku gaya nuklir kuat. Gaya nuklir kuat ieu kacida kuatna lamun dibandingkeun jeung gaya gravitasi atawa jeung gaya éléktromagnét, tapi alatan gaya nuklir kuat ieu ngan digawé dina jarak anu pohara pondok (kabalikan tina gaya gravitasi sarta éléktromagnét anu miboga hontalan teu kahingga) urang henteu bisa ngarasakeunana dina kahirupan sapopoé. Hidrogén nyaéta hiji-hijina unsur anu henteu miboga neutron dina intina; inti hidrogén ngan diwangun ku 1 proton. Wangun stabil tina hélium, unsur panghampangna sanggeus hidrogén, miboga 2 proton jeung 2 neutron. lolobana unsur hampang stabil lamun miboga jumlah neutron jeung proton anu saimbang, tapi beuki beurat/gedé hiji unsur, manéhna baris merlukeun leuwih réa neutron pikeun tetep silih iket babarengan.
Isotop
éditIsotop hiji atom ditangtukeun ku jumlah neutron dina jero intina. Isotop-isotop ti hiji unsur anu sarua miboga sipat kimia anu kacida mirupa alatan reaksi kimia ampir gumantung sagemblengna kana jumlah éléktron anu dipiboga hiji atom. Isotop-isotop tina sampel sahiji unsur nu tangtu bisa dipisahkeun ku cara ngagunakeun séntrifugasi atawa spéktométer massa. Cara kahiji dipaké pikeun mroduksi uranium nu dibeungharan tina hiji sampel uranium biasa sarta cara anu kadua dipaké dina padika pananggalan karbon (carbon dating).
Jumlah proton jeung neutron nangtukeun jinis nukleus atawa inti atom. Proton sarta neutron ampir mibanda massa anu sarua, sarta gabungan jumlahna, jumlah massana, rata-rata sarua jeung massa atomik hiji atom. Gabungan massa éléktron pohara leutik dibandingkeun jeung massa nukleus dilantarankeun beurat proton jeung neutron ampir 2000 kali massa éléktron.